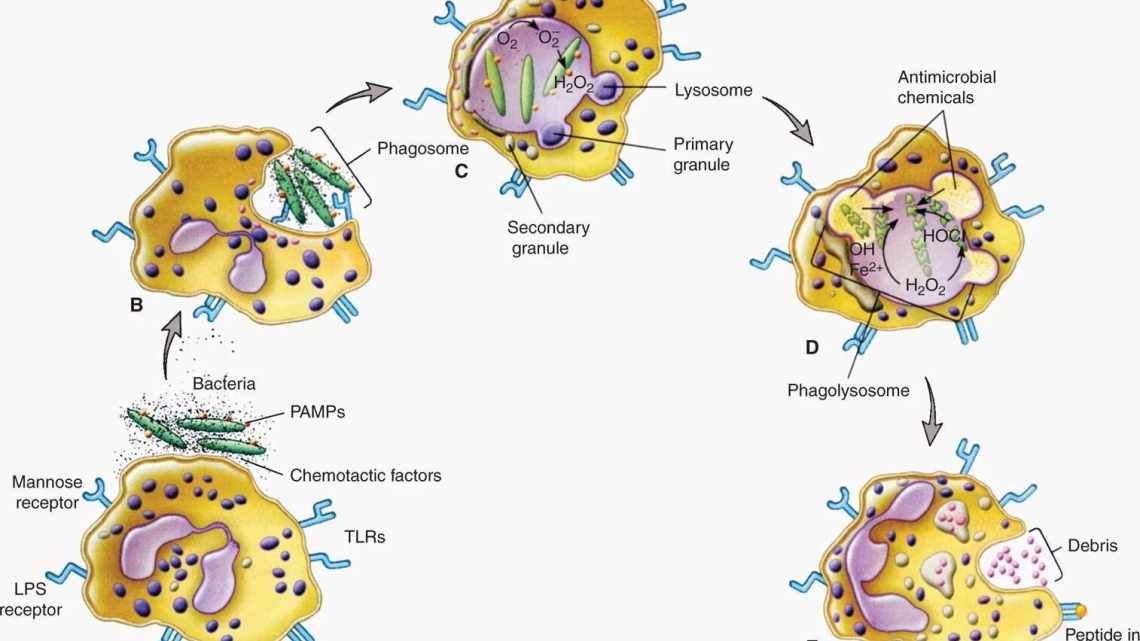
Ліпідні медіатори завадили макрофагам фагоцитувати пневмококи
Вчені встановили, що при підвищеній концентрації епоксиейкозатрієнових кислот (ЄЕТ) - медіаторів активності імунної системи - макрофаги гірше розпізнають пневмококи і не фагоцитують їх. При цьому експерименти показали, що антагоніст рецептора МАЄ відновлює фагоцитоз до нормального рівня. Потенційно ця регуляція може стати основою для лікування пневмонії без використання антибіотиків. Дослідження опубліковано в
Висока активність імунної відповіді організму на патоген може пошкодити клітини і тканини господаря. Щоб цього не сталося, макрофаги секретують спеціальні медіатори, здатні як посилювати запалення, так і знижувати його. До таких медіаторів належать епоксиейкозатрієнові кислоти (EET), які мають високу протизапальну активність. Щоб контролювати її рівень, макрофаги також секретують епоксигідролазу, яка гідролізує ЄЕТ до менш активної форми - дигідроксіейкозатріенових кислот. Таким чином, епоксигідролаза відіграє важливу фізіологічну роль у регулюванні рівнів ліпідних сигнальних молекул. Проте досі незрозуміло, як ці молекули впливають на активність і чутливість до патогенів самих макрофагів.
Група вчених з Національного інституту здоров'я під керівництвом Лі Хуна (Li Hong) досліджувала регуляцію швидкості виведення з організму (кліренса) бактерій при пневмонії за допомогою EET і епоксигідролази. Для експериментів автори використовували мишей з нокаутованим геном епоксигідролази, тобто з підвищеною кількістю епоксіейкозатрієнових кислот, для альвеолярні макрофаги цих же тварин.
Оскільки гідролази активно експресуються у відповідь на присутність ліпополісахаридів (компонента оболонки грамотрицьких бактерій), необхідно було з'ясувати, як відсутність цього ферменту і підвищена концентрація EET впливає на швидкість виведення патогенних бактерій з організму. Для цього дослідники ввели три штами, що викликають пневмонію: грампольожні та грамотрицькі. Експеримент проводили на групах мишей від п'яти до десяти особин. Вже через 12 годин після введення кількість пневмокока була набагато вище контрольної групи (p < 0,05), при цьому кількість бактерій інших штамів залишалася однаковою. Далі мишам вводили синтетичну молекулу EEZE - антагоніста рецептора EET. Це підвищувало кліренс до рівнів дикого типу. А флуоресцентне фарбування підтвердило, що макрофаги випробовуваної групи мишей набагато гірше фагоцитують пневмококи, ніж макрофаги мишей дикого типу.
Автори роботи вважають, що селективність фагоцитоза при підвищених концентраціях МАЄ може бути викликана змінами в образ-розпізнаючих рецепторах на поверхні імунної клітини. Експерименти на клітинних культурах макрофагів показали, що пептидоглікан, який знаходиться в складі клітинної оболонки, викликає підвищення рівня EET у досліджуваних зразків (p < 0,05). А при аналізі рівня мРНК цитокінів вчені виявили, що відсутність епоксигідролази призвела до зниження рівня провоспальних цитокінів і рецепторів розпізнавання паттерів, зокрема, до пептидоглікану (p < 0,05). Більш того, в нокаутованих макрофагах знизилася кількість білків, що активують фагоцитоз в клітці, зокрема Rac1 і Cdc42 (p < 0,05).
Щоб визначити, чи можуть епоксіейкозатрієнові кислоти в макрофагах людини регулювати продукцію цитокінів, експресію рецепторів і фагоцитоз, біологи додали в середу до альвеолярних макрофаг людини підвищену концентрацію EET. З'ясувалося, що навіть у макрофагах людини епоксиейкозатрієнові кислоти знижують активність фагоцитозу, знижують синтез цитокінів і рецепторів (p < 0,05).
Разом всі ці дані показують, що епоксигідролаза необхідна для максимально ефективної імунної відповіді організму на патогенну бактерію. Раніше вчені пропонували використовувати інгібітори епоксигідролази для лікування серцево-судинних захворювань, автори даного дослідження застерігають, що збільшення концентрації EET може негативно впливати на ефективність вродженого імунітету. Тим не менш, боротьба з патогенними бактеріями за допомогою регуляції імунної відповіді може стати потенційно новим підходом до лікування пневмонії.
Вчені вже давно намагаються обійти резистентність бактерій до антибіотиків: знаходять слабкі місця у зовнішній мембрані кишкової палички, направляють до бактерій фагів, які відбирають гени стійкості. А в іншій роботі з'ясували, що при боротьбі бактерій з бактеріофагами вони стають вразливими для антибіотиків.
